CD8+ T细胞是免疫系统中的细胞毒性淋巴细胞,能够通过释放细胞毒素并诱导靶细胞死亡,清除被感染或发生异常的细胞。作为免疫治疗的前沿手段,CD8+ T细胞疗法已取得进展。然而,肿瘤微环境常通过抑制性信号传导和免疫逃逸机制限制CD8+ T细胞的功能,阻碍其治疗效果,成为当前免疫治疗面临的挑战。
近日,中国科学院国家纳米科学中心研究员王海团队发现,肿瘤细胞内线粒体含量与其对CD8+ T细胞杀伤的敏感性相关。线粒体含量低的肿瘤细胞更易被CD8+ T细胞杀伤,而线粒体含量高的则更易存活。进一步,基于这一现象,团队开发出纳米诱导剂——mitoNIDs,可选择性降解肿瘤细胞中的线粒体,增强CD8+ T细胞的特异性杀伤能力。这一策略提升了多种免疫治疗手段的疗效。
mitoNIDs可以通过邻近诱导效应促进线粒体与自噬相关蛋白LC3结合,导致肿瘤细胞内线粒体经自噬途径选择性降解。研究发现,mitoNIDs诱导的肿瘤细胞内线粒体含量降低,上调了I类主要组织相容性复合体表达,提升抗原呈递效率;抑制抗凋亡蛋白BCL-XL,削弱肿瘤细胞的抗凋亡能力,增强了其对CD8+ T细胞介导的免疫杀伤的敏感性。同时,mitoNIDs介导的线粒体降解还可改变肿瘤细胞的代谢状态,促进溶血磷脂酰肌醇释放,以激活CD8+ T细胞的G蛋白偶联受体55-ErK信号通路,增强CD8+ T细胞的活化与增殖。体内实验验证发现,mitoNIDs通过调控线粒体降解,增强过继性T细胞疗法、CAR-T细胞治疗及个性化mRNA疫苗等免疫疗法的抗肿瘤效果。
上述研究设计的可调控肿瘤细胞内线粒体代谢过程的纳米诱导剂,能够通过多重机制增强CD8+ T细胞的细胞毒性反应,为癌症免疫治疗提出了新思路。
相关研究成果发表在《自然-纳米技术》(Nature Nanotechnology)上。研究工作得到国家自然科学基金等的支持。
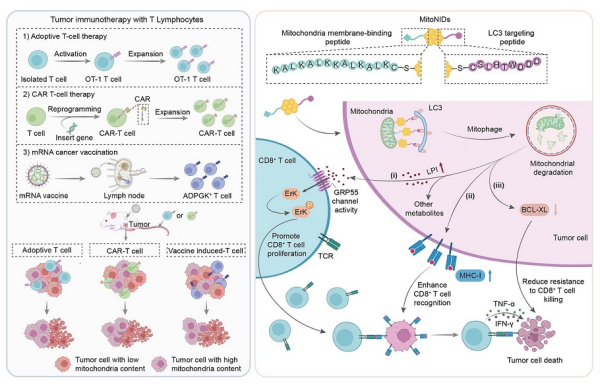
纳米诱导剂介导的线粒体选择性降解增强CD8+ T细胞免疫疗法示意图
扫一扫在手机打开当前页面






 贵公网安备 52010302000247号
贵公网安备 52010302000247号
